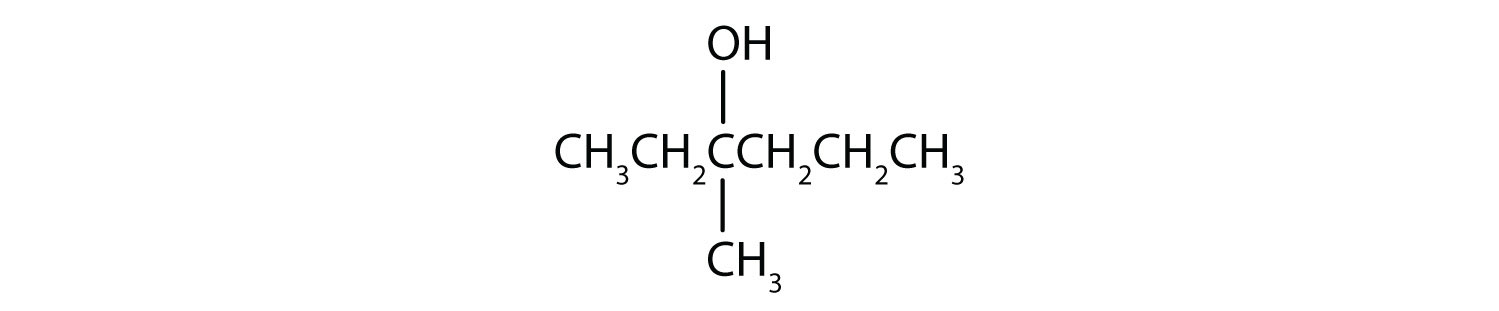
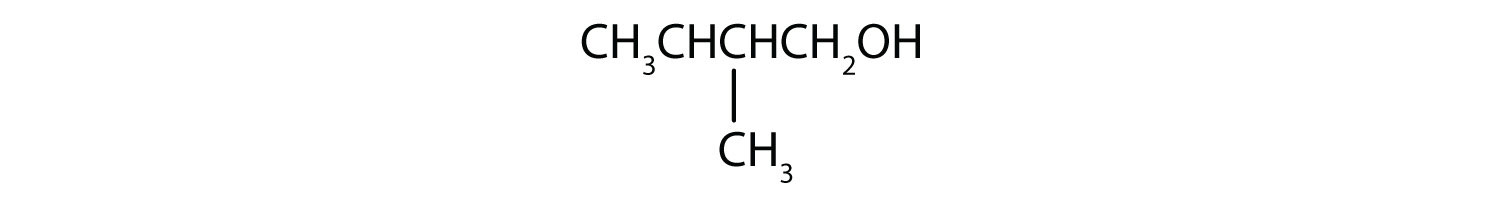
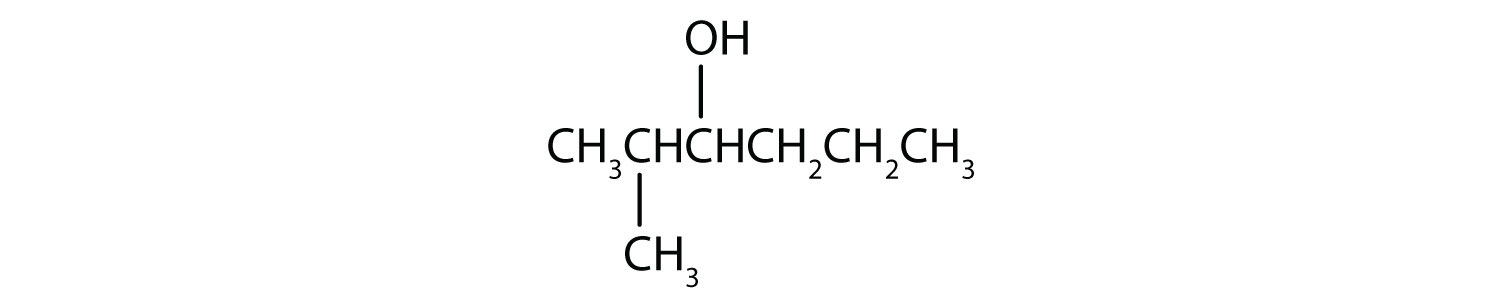
واکنشهای شیمیایی در الکلها عمدتاً در گروه عاملی رخ میدهد، اما برخی شامل اتمهای هیدروژن متصل به اتم کربن حامل OH یا یک اتم کربن مجاور هستند. از سه نوع عمده واکنش های الکلی که در شکل خلاصه شده است27.4. 127.4.1دو – کم آبی و اکسیداسیون – در اینجا در نظر گرفته شده است. نوع سوم واکنش – استریفیکاسیون – در جای دیگری پوشش داده شده است.
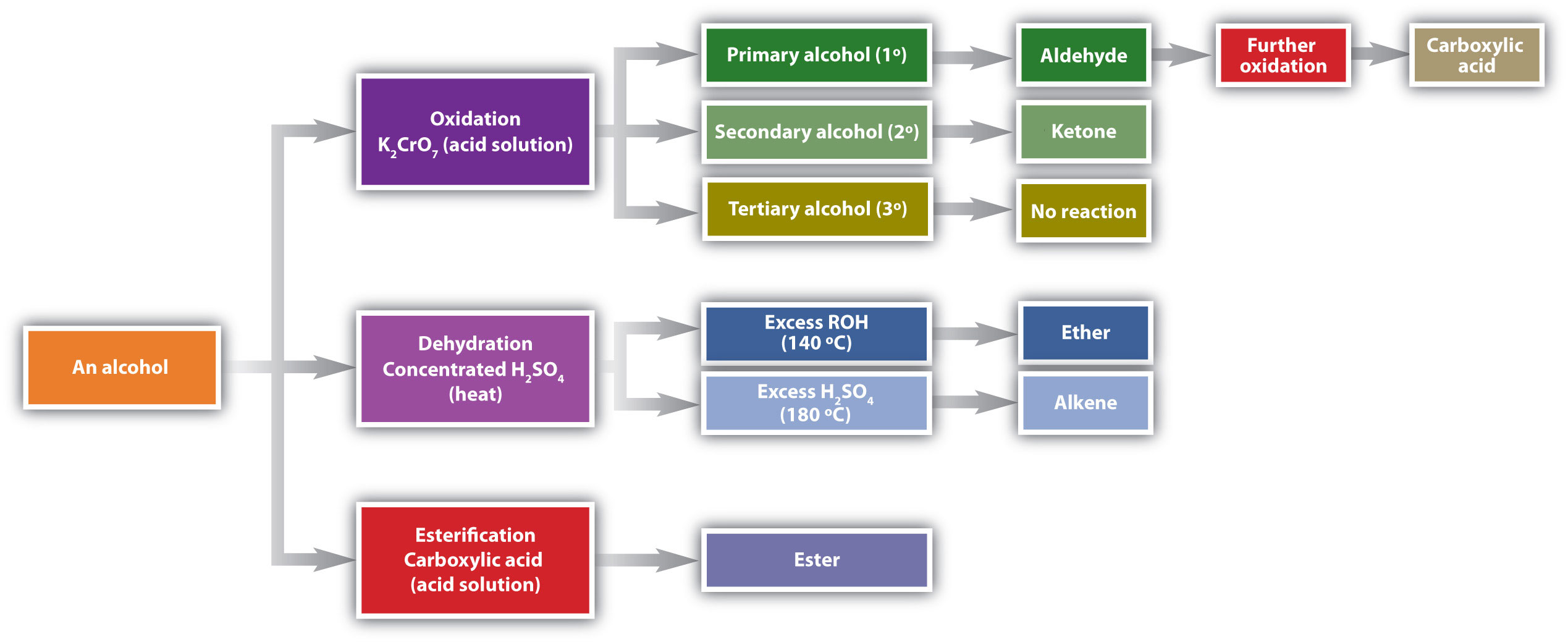
جدول 27.4. 127.4.1: واکنش های الکل ها. در اینجا اکسیداسیون و کم آبی الکل ها در نظر گرفته می شود.
کم آبی الکل ها
همانطور که در شکل ذکر شده است27.4. 127.4.1یک الکل در حضور یک کاتالیزور دچار کم آبی می شود و یک آلکن و آب تشکیل می دهد. این واکنش گروه OH را از اتم کربن الکل و یک اتم هیدروژن را از یک اتم کربن مجاور در همان مولکول حذف می کند:
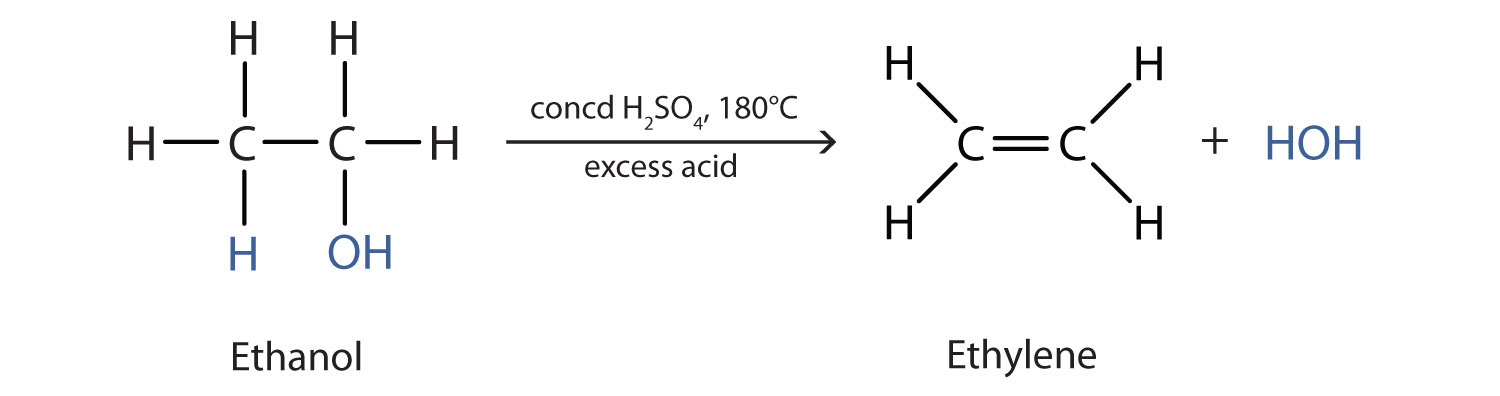
در شرایط مناسب، ممکن است کم آبی بین دو مولکول الکل رخ دهد. کل گروه OH یک مولکول و فقط اتم هیدروژن از گروه OH مولکول دوم حذف می شوند. دو گروه اتیل متصل به اتم اکسیژن یک مولکول اتر را تشکیل می دهند.
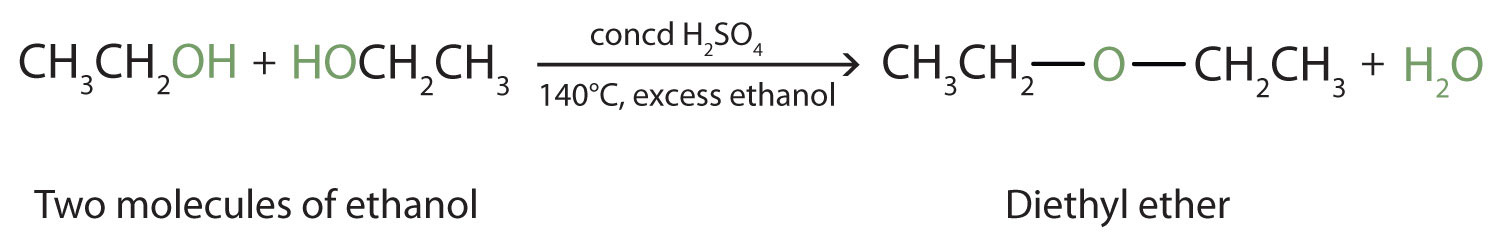
( اترها در جاهای دیگر مورد بحث قرار گرفته اند ) بنابراین، بسته به شرایط، می توان آلکن ها یا اترها را با آبگیری الکل ها تهیه کرد.
توجه داشته باشید
هر دو واکنش کم آبی و هیدراتاسیون به طور مداوم در متابولیسم سلولی رخ می دهد، با آنزیم ها به عنوان کاتالیزور و در دمای حدود 37 درجه سانتی گراد. واکنش زیر در مسیر “Embden-Meyerhof” رخ می دهد
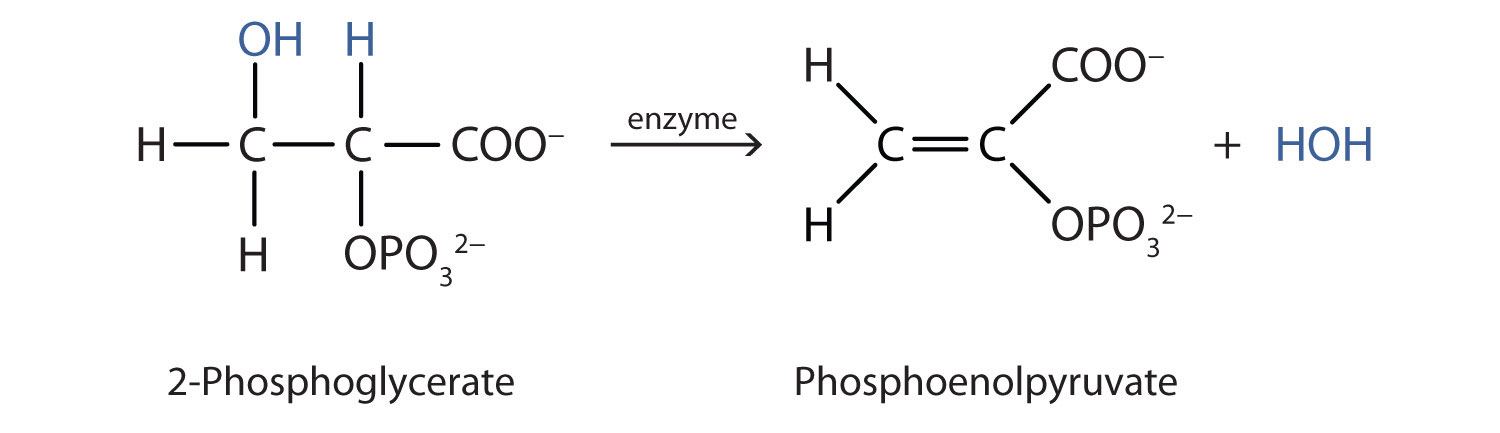
اگرچه ترکیبات شرکت کننده پیچیده هستند، واکنش یکسان است: حذف آب از ماده اولیه. ایده این است که اگر شیمی یک گروه عاملی خاص را بدانید، شیمی صدها ترکیب مختلف را می دانید.
اکسیداسیون آکوهل ها
الکل های اولیه و ثانویه به راحتی اکسید می شوند. قبلاً دیدیم که چگونه متانول و اتانول توسط آنزیم های کبدی اکسید می شوند و آلدهیدها را تشکیل می دهند. از آنجایی که انواع عوامل اکسید کننده می توانند باعث اکسیداسیون شوند، می توانیم با نوشتن معادله ای با علامت [O] در بالای فلش، یک عامل اکسید کننده را بدون مشخص کردن عامل خاصی نشان دهیم. به عنوان مثال، اکسیداسیون اتانول – یک الکل اولیه – برای تشکیل استالدئید – یک آلدئید – را به صورت زیر می نویسیم:
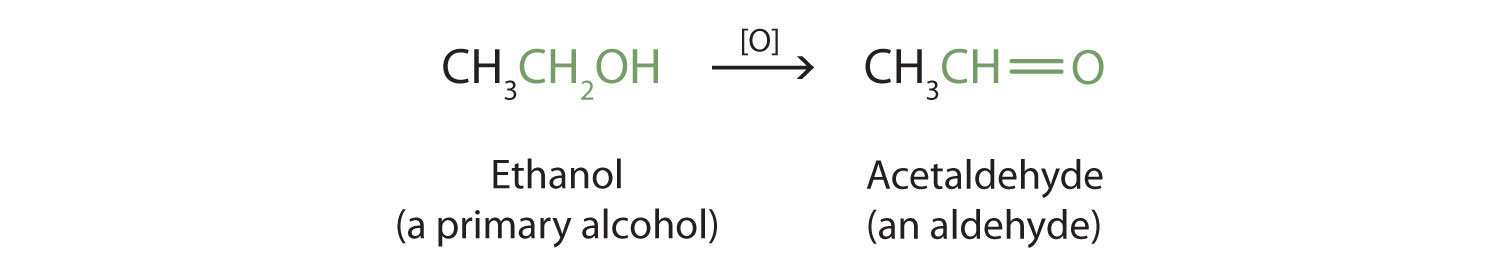
خواهیم دید که آلدئیدها حتی راحت تر از الکل ها اکسید می شوند و اسیدهای کربوکسیلیک تولید می کنند. الکل های ثانویه به کتون اکسید می شوند . اکسیداسیون ایزوپروپیل الکل توسط دی کرومات پتاسیم (K 2 Cr 2 O 7 ) استون ، ساده ترین کتون را می دهد:
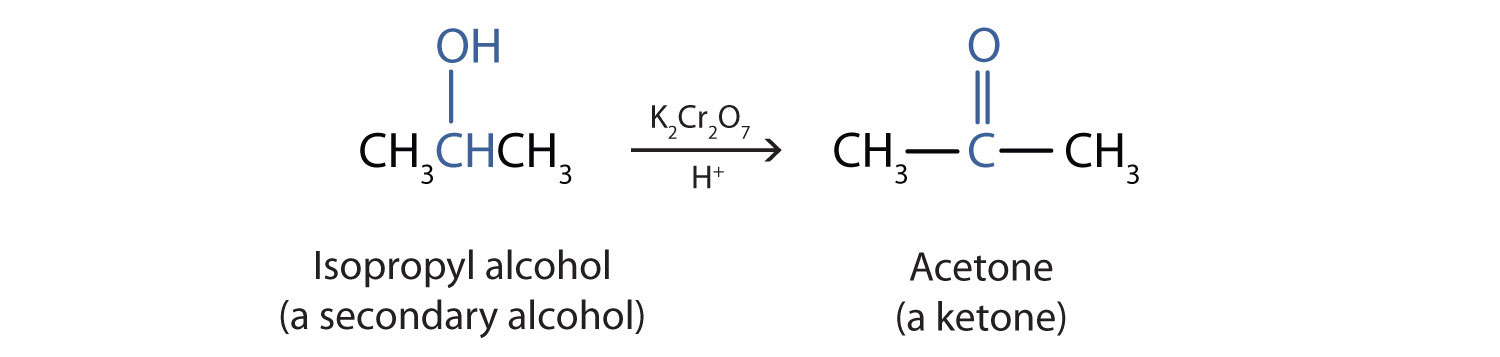
بر خلاف آلدئیدها، کتون ها نسبتاً در برابر اکسیداسیون بیشتر مقاوم هستند، بنابراین هیچ احتیاط خاصی برای جداسازی آنها در زمان تشکیل لازم نیست. توجه داشته باشید که در اکسیداسیون هر دو الکل اولیه (RCH 2 OH) و ثانویه (R 2 CHOH) دو اتم هیدروژن از مولکول الکل حذف می شود، یکی از گروه OH و دیگری از اتم کربن که دارای گروه OH است.
توجه داشته باشید
این واکنش ها را می توان در آزمایشگاه با عوامل اکسید کننده شیمیایی نیز انجام داد. یکی از این عوامل اکسید کننده دی کرومات پتاسیم است. معادله متعادل (که فقط گونه های درگیر در واکنش را نشان می دهد) در این مورد به شرح زیر است:
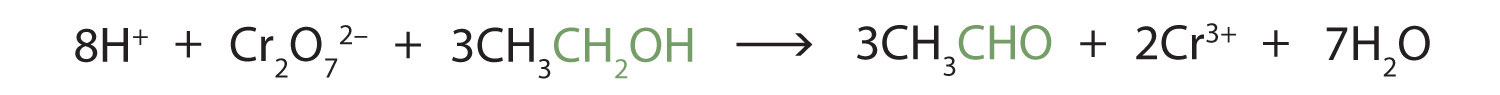

نوع کلی واکنش مانند واکنش در تبدیل ایزوپروپیل الکل به استون است.
الکل های سوم (R 3 COH) در برابر اکسیداسیون مقاوم هستند زیرا اتم کربنی که گروه OH را حمل می کند اتم هیدروژن متصل نیست بلکه به اتم های کربن دیگر متصل است. واکنش های اکسیداسیونی که توضیح دادیم شامل تشکیل پیوند دوگانه کربن به اکسیژن است. بنابراین، اتم کربن حامل گروه OH باید بتواند یکی از اتم های متصل خود را آزاد کند تا پیوند دوگانه را تشکیل دهد. پیوند کربن به هیدروژن در شرایط اکسیداتیو به راحتی شکسته می شود، اما پیوندهای کربن به کربن اینطور نیست. بنابراین الکل های سوم به راحتی اکسید نمی شوند.
مثال27.4. 127.4.1
معادله ای برای اکسیداسیون هر الکل بنویسید. از [O] بالای پیکان برای نشان دادن یک عامل اکسید کننده استفاده کنید. اگر هیچ واکنشی رخ نداد، بعد از فلش «بدون واکنش» بنویسید.
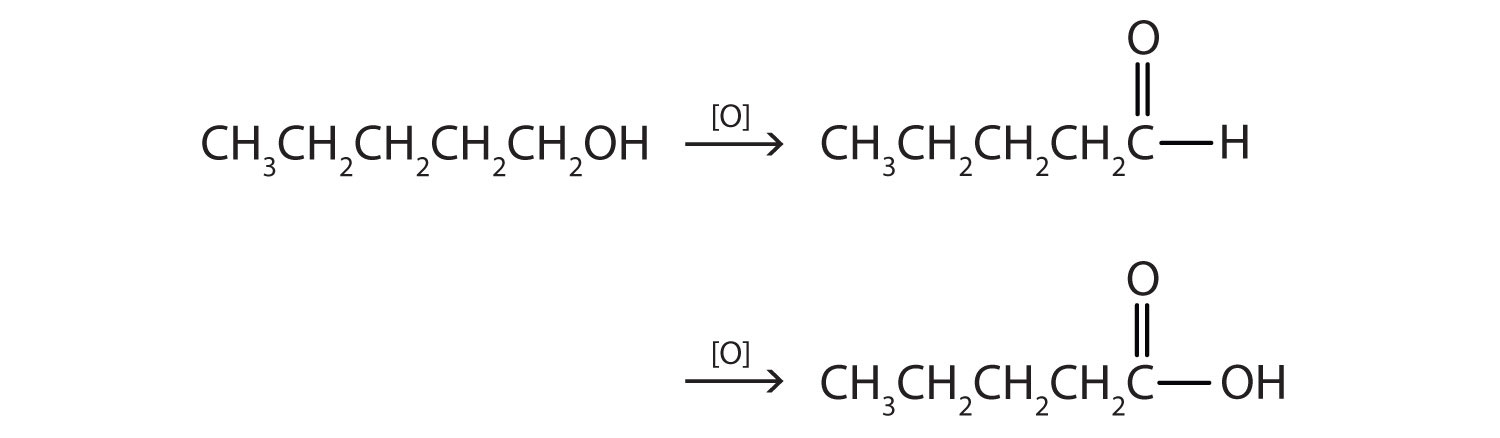
- CH 3 CH 2 CH 2 CH 2 CH 2 OH
-
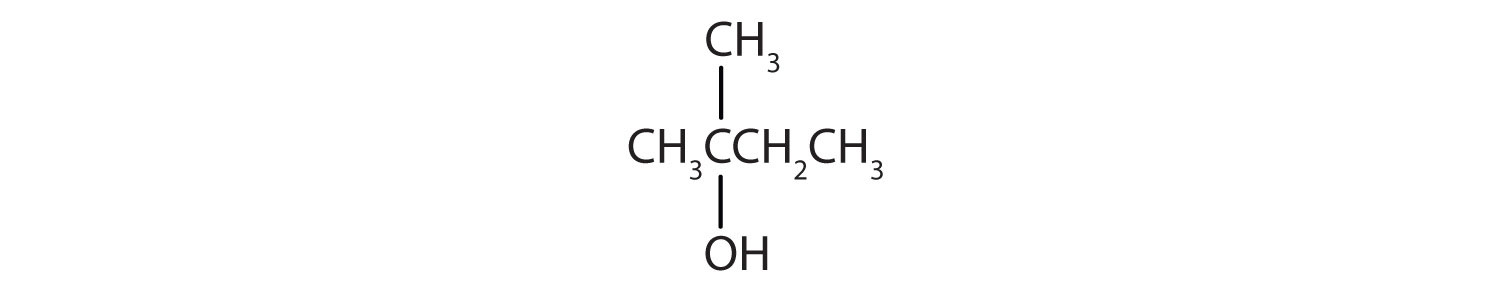
-

راه حل
اولین قدم این است که کلاس هر الکل را به عنوان اولیه، ثانویه یا سوم تشخیص دهید.
- این الکل دارای گروه OH روی یک اتم کربن است که فقط به یک اتم کربن دیگر متصل است، بنابراین یک الکل اولیه است. اکسیداسیون ابتدا یک آلدهید و اکسیداسیون بعدی یک اسید کربوکسیلیک را تشکیل می دهد.
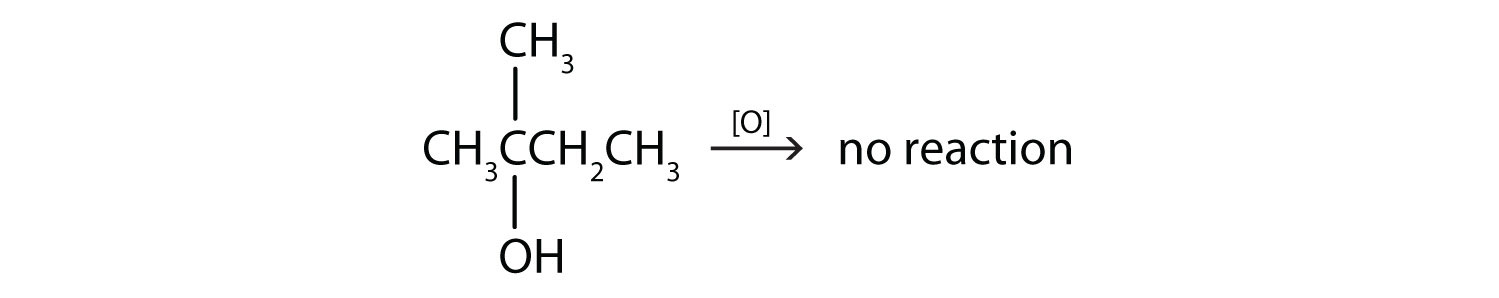
- این الکل دارای گروه OH روی یک اتم کربن است که به سه اتم کربن دیگر متصل است، بنابراین یک الکل سوم است. هیچ واکنشی رخ نمی دهد.
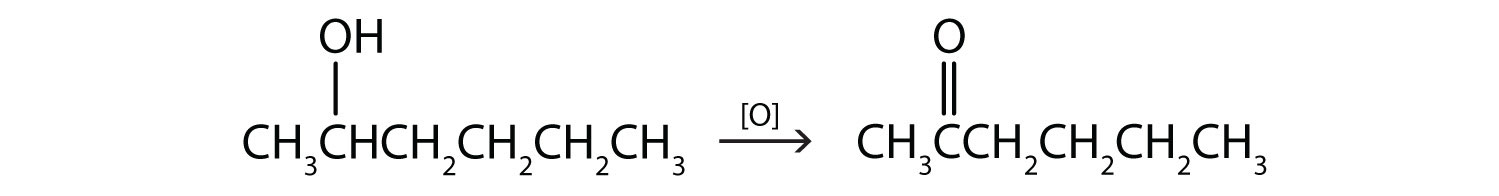
- این الکل دارای گروه OH روی یک اتم کربن است که به دو اتم کربن دیگر متصل است، بنابراین یک الکل ثانویه است. اکسیداسیون یک کتون می دهد.
ورزش27.4. 127.4.1
معادله ای برای اکسیداسیون هر الکل بنویسید. از [O] بالای پیکان برای نشان دادن یک عامل اکسید کننده استفاده کنید. اگر هیچ واکنشی رخ نداد، بعد از فلش «بدون واکنش» بنویسید.
واکنش الکل ها با هالیدهای هیدروژن (HX)
هنگامی که الکل ها با یک هیدروژن هالید واکنش می دهند، یک جایگزینی رخ می دهد و یک آلکیل هالید و آب تولید می کند:
- ترتیب واکنش الکل ها 3° > 2° > 1° متیل است.
- ترتیب واکنش هالیدهای هیدروژن HI > HBr > HCl است (HF به طور کلی غیر واکنشی است).
واکنش کاتالیزور اسیدی می شود. الکل ها با هالیدهای هیدروژن قوی اسیدی HCl، HBr و HI واکنش می دهند، اما با NaCl، NaBr یا NaI غیر اسیدی واکنش نمی دهند. الکل های اولیه و ثانویه را می توان با اجازه دادن به آنها برای واکنش با مخلوطی از هالید سدیم و اسید سولفوریک به آلکیل کلرید و برومید تبدیل کرد:
به نظر می رسد الکل های ثانویه، سوم، آلیلیک و بنزیلیک با مکانیسمی واکنش نشان می دهند که شامل تشکیل یک کربوکاتیون در یکاسن1اسن1واکنش با الکل پروتونه که به عنوان سوبسترا عمل می کند. ایناسن1اسن1مکانیسم با واکنش ترت بوتیل الکل و اسید هیدروکلریک آبی نشان داده شده است.اچ3O+اچ3�+،سیل–سیل-). دو مرحله اول در ایناسn1اس�1مکانیسم جایگزینی پروتونه شدن الکل برای تشکیل یون اکسونیوم است. اگرچه یون اکسونیوم از پروتونه شدن الکل تشکیل می شود، اما می توان آن را به عنوان یک کمپلکس اسید-باز لوئیس بین کاتیون نیز مشاهده کرد.آر+آر+) واچ2Oاچ2�. پروتوناسیون الکل یک گروه ترک ضعیف (OH-) را به یک گروه خروجی خوب (\)H_2O\_ تبدیل می کند که باعث می شود مرحله تفکیکاسن1اسن1مکانیسم مطلوب تر است.
در مرحله 3، کربوکاتیون با یک نوکلئوفیل (یون هالید) واکنش می دهد تا جایگزینی کامل شود.
وقتی یک الکل را به آلکیل هالید تبدیل می کنیم، واکنش را در حضور اسید و در حضور یون های هالید و نه در دمای بالا انجام می دهیم. یون های هالید هسته دوست های خوبی هستند (آنها هسته دوست های بسیار قوی تر از آب هستند) و از آنجایی که یون های هالید در غلظت بالایی وجود دارند، بیشتر کربوکاتیون ها با یک جفت الکترونی از یون هالید واکنش می دهند تا گونه ای پایدارتر، محصول آلکیل هالید را تشکیل دهند. . نتیجه کلی یک استاسn1اس�1واکنش.
همه تبدیلهای اسیدی الکلها به آلکیل هالیدها از طریق تشکیل کربوکاتیونها انجام نمیشود. الکل های اولیه و متانول در شرایط اسیدی با مکانیسم SN2 واکنش نشان می دهند و آلکیل هالید تشکیل می دهند . در این واکنش ها، عملکرد اسید تولید الکل پروتونه است . سپس یون هالید یک مولکول آب (گروه ترک خوب) را از کربن جابجا می کند. این یک آلکیل هالید تولید می کند:
باز هم اسید مورد نیاز است. اگرچه یون های هالید (به ویژه یون های یدید و برمید) هسته دوست های قوی هستند، اما به اندازه کافی قوی نیستند که بتوانند واکنش های جایگزینی را با خود الکل ها انجام دهند. جابجایی مستقیم گروه هیدروکسیل رخ نمی دهد زیرا گروه ترک باید یک یون هیدروکسید قویا بازی باشد:
اکنون میتوانیم ببینیم که چرا واکنشهای الکلها با هالیدهای هیدروژن توسط اسید پیش میرود.
اسید گروه هیدروکسیل الکل را پروتونه می کند و آن را به یک گروه ترک خوب تبدیل می کند. با این حال، می توان از اسیدهای لوئیس قوی دیگر به جای اسیدهای هیدروهالیک استفاده کرد. از آنجایی که یون کلرید هسته دوست ضعیف تری نسبت به یون های برمید یا یدید است، کلرید هیدروژن با الکل های اولیه یا ثانویه واکنش نمی دهد مگر اینکه کلرید روی یا اسید لوئیس مشابه نیز به مخلوط واکنش اضافه شود. کلرید روی، یک اسید لوئیس خوب، از طریق ارتباط با یک جفت الکترون مشترک روی اتم اکسیژن، با الکل کمپلکسی تشکیل می دهد. این پتانسیل گروه ترک هیدروکسیل را به اندازه کافی افزایش می دهد تا کلرید بتواند آن را جابجا کند.
همانطور که ممکن است انتظار داشته باشیم، بسیاری از واکنش های الکل ها با هالیدهای هیدروژن، به ویژه آنهایی که در آنها کربوکاتیون ها تشکیل می شوند، با بازآرایی همراه است. قاعده کلی این است که اگر بازآرایی می تواند رخ دهد (برای تشکیل کاتیون های پایدارتر یا به همان اندازه پایدار)، این اتفاق خواهد افتاد! در این واکنش ها می توان مخلوطی از محصولات ایجاد کرد.